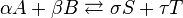Vamos a preparar una disolución reguladora,
vamos a determinar su pH y analizaremos su capacidad amortiguadora, y mediremos
la variación de pH que obtendrá la disolución al adicionarle un ácido fuerte y
una base fuerte.
Una disolución reguladora (también llamada amortiguadora, tampón
o "buffer") es una disolución capaz de mantener el pH casi constante
cuando se le añaden cantidades moderadas de un ácido o de una base.
Una disolución reguladora debe contener una concentración de
ácido suficiente para reaccionar con la base (OH-) que se añada y,
también, una concentración de base apropiada para reaccionar con el ácido (H3O+)
añadido.
Una disolución reguladora se prepara mezclando dos solutos: o
bien, un ácido débil (HA) y su base conjugada (A-); o bien, una base
débil (B) y su ácido conjugado (HB+).
La especie ácida de la
disolución reguladora se denomina “reserva
ácida” mientras que la parte básica de la disolución reguladora se denomina
“reserva básica o alcalina”. La
capacidad amortiguadora depende de la cantidad (concentración) de reserva ácida
y básica que tenga la disolución reguladora.
Reactivos
utilizados en la práctica:
Ácido acético,
Ácido metilencarboxílico o ácido etanoico, se puede encontrar en forma de ion acetato. Éste es un ácido que se encuentra en
el vinagre, siendo el principal responsable de su sabor y olor agrios.
Acetato de sódio,
El acetato de sodio, (también llamado,
etanoato de sodio) es la sal de sodio del ácido acético.Una solución hiper-saturada de acetato de sodio en
agua (disolviendo el acetato de sodio en agua caliente y posteriormente
enfriando la solución), cristaliza de forma rápida y es lo que comúnmente se
conoce como Hot
Ice.
Hidróxido de
sódio, NaOH,
El hidróxido de sodio (NaOH) o hidróxido sódico, también conocido
como soda cáustica o sosa cáustica.
Ácido
clorhídrico, HCl,
El ácido clorhídrico, ácido muriático, espíritu de sal, ácido marino, ácido de salo todavía ocasionalmente llamado, ácido hidroclórico (por
su extracción a partir de sal marina en América), agua fuerte o salfumán (en
España), es una disolución acuosa del gas cloruro de hidrógeno (HCl). Es muy corrosivo y ácido.Se trata de un ácido
fuerte que se disocia
completamente en disolución acuosa.
Fenolftaleína
La fenolftaleína es un indicador de pH que
en soluciones ácidas permanece incoloro, pero en presencia de bases toma un
color rosado con un punto de viraje entre pH=8,0 (Incoloro) a pH=9,8 (Magenta o
rosado). Es un compuesto químico orgánico que se obtiene por reacción del fenol
y el anhídrido
ftálico en
presencia de ácido sulfúrico.
Anaranjado de metilo
Anaranjado de metilo es un colorante azoderivado, con cambio de color de rojo a naranja-amarillo entre pH 3,1 y 4,4. El nombre del compuesto químico del indicador es
sal sódica de ácido
sulfónico de 4-Dimetilaminoazobenceno.
La disolución reguladora
tiene la capacidad de resistir los cambios de pH cuando se adicionan pequeñas
cantidades de un ácido o de una base fuertes. Una disolución amortiguadora debe
contener una concentración relativamente grande de ácido para reaccionar con
los iones hidroxilo que se le añadan; y también debe contener una concentración
semejante de base para neutralizar los iones hidronio que se le añadan. La
cantidad de ácido o base que se puede agregar a una disolución amortiguadora
antes de cambiar de forma significativa su pH se denomina capacidad amortiguadora.
En una disolución reguladora que contiene ácido acético y
acetato de sodio, ambas especies se disocian para dar iones acetato (ión
común). El acetato de sodio es un electrolito fuerte, y se disocia por completo en
disolución, mientras que el ácido acético es un ácido débil, y se disocia sólo
en parte.
De acuerdo con el principio
de Le Châtelier la adición de iones acetato, provenientes del acetato de sodio,
disminuye la disociación del CH3COOH (efecto de ión común).
La
concentración del anión acetato en el equilibrio, es prácticamente igual a la
concentración inicial de la sal.
Por la misma razón, la concentración de CH3COOH
en el equilibrio es prácticamente igual a la adicionada inicialmente.
Se observa que el pH
depende de la relación de concentraciones de la sal y del ácido y, por
consiguiente, no ha de variar con la dilución, porque la citada relación
permanecerá invariable entre ciertos límites.
Si a esta disolución reguladora se
le añade una pequeña cantidad de ácido, aunque éste sea fuerte, la base
conjugada de la disolución reguladora (iones CH3COOˉ) consumirá los
iones H3O+ procedentes del ácido de acuerdo con el
equilibrio.
Si, por el contrario, se adiciona una base, la
reserva ácida de la disolución reguladora (ácido acético) neutralizará los
iones HOˉ procedentes de la base según el siguiente equilibrio.
La capacidad amortiguadora
depende de la cantidad de ácido y de base conjugada que tenga la disolución.
Algunas disoluciones reguladoras
comunes son:
Ácido
acético/ión acetato (sal de sodio o potasio), CH3COOH(ac)/CH3COO⁻(ac)
Ácido
fluorhídrico/ión fluoruro (sal de sodio o potasio), HF(ac)/F⁻(ac)
Cloruro
de amonio/amoniaco, NH4+(ac)/NH3(ac)
Ácido láctico/ión
lactato (sal de sodio o potasio), C3H5O3H(ac)/C3H5O3⁻(ac)